 澳大最新研究发现抑制乳腺癌转移和复发新机制
澳大最新研究发现抑制乳腺癌转移和复发新机制
由澳门大学健康科学学院院长邓初夏教授带领的研究团队发现,乳腺癌相关基因1(BRCA1)可通过促进线粒体自噬及降低炎症小体活性,抑制手术后乳腺癌的复发及转移。此研究获国家自然科学基金、澳门大学和澳门科技发展基金会资助,并作为封面文章发表在国际着名期刊《Advanced Science》(《先进科学》)。
全球癌症统计(GLOBOCAN)数据显示,2018年全球有大约1810万癌症新发病例和960万癌症死亡病例,而其中女性乳腺癌占210万例,63万人死亡,已成为威胁女性健康的第一癌症杀手。临床上可对乳腺癌进行病理分型,其中雌激素受体(ER)、孕酮受体(PR)和表皮生长因子受体-2(Her-2)均为阴性的乳腺癌称为三阴性乳腺癌,占所有乳腺癌病理类型的10.0-20.8%。这类癌症缺乏获批准的靶向治疗方法并且易复发及转移,是最为难治及恶性程度最高的乳腺癌。因此,当前迫切需要为三阴性乳腺癌治疗找到新颖有效的靶标。
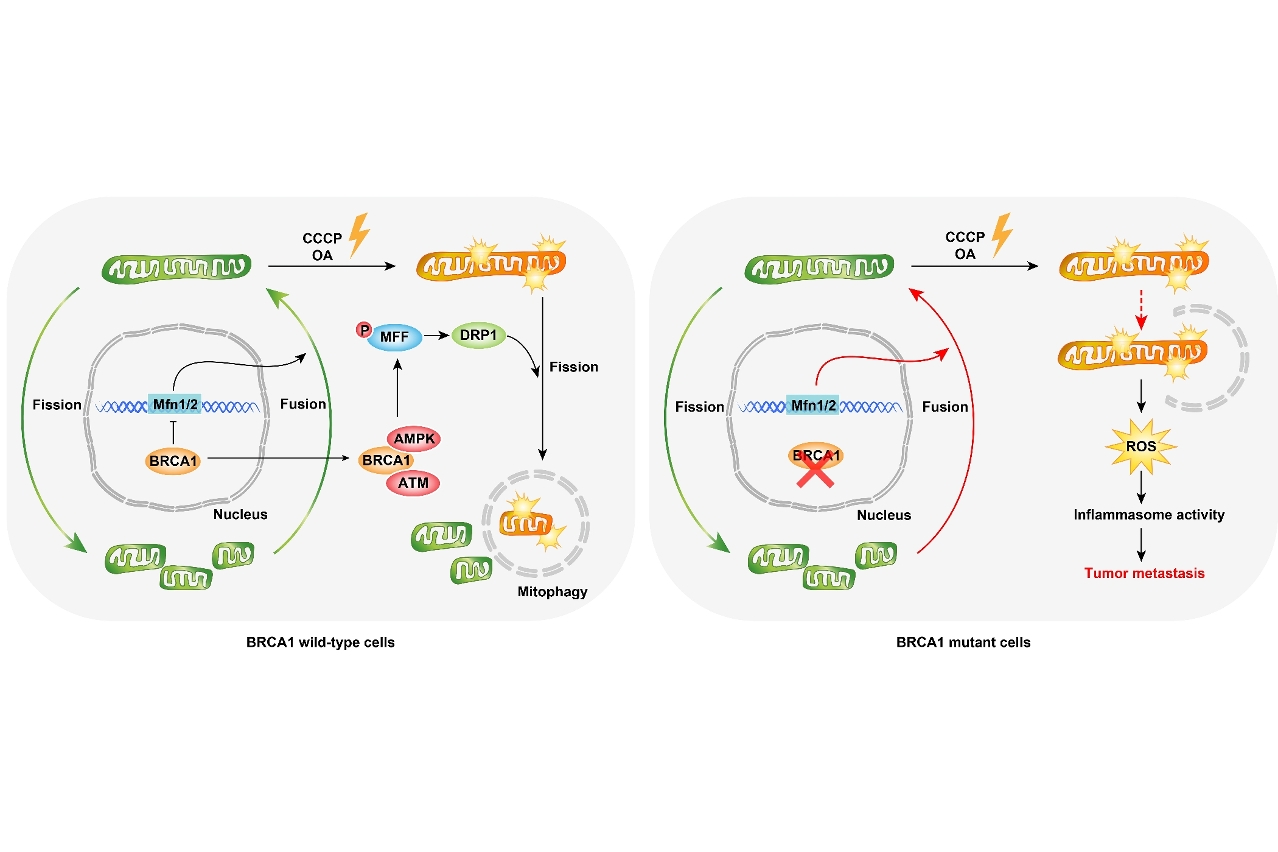
BRCA1是重要的抑癌基因,在维持细胞基因组稳定性中发挥重要作用,其突变提高女性罹患乳腺癌的风险,是导致遗传型乳腺癌的主要原因,并且多数为三阴性乳腺癌。最近,澳门大学健康科学学院研究团队利用携带BRCA1乳腺特异敲除的小鼠进行研究,发现BRCA1在线粒体自噬及线粒体动力学方面具有重要调控作用,可通过促进线粒体自噬清除损伤线粒体及降低炎症小体活性来抑制手术后乳腺癌的复发及转移。
线粒体是在大多数真核细胞中存在的双膜结构及高度动态的细胞器,可以通过分裂及融合的协调循环即线粒体动力学,来保持形状、分布和大小。线粒体不仅是细胞的动力工厂,而且在细胞信号转导及细胞死亡等方面也具有重要作用。因此,维持正常的线粒体功能对于细胞的健康至关重要。近年来,研究表明受损的线粒体可通过与溶酶体融合形成自噬体而水解消化,从而及时清除受损的线粒体来维持细胞的完整性,这一过程称为线粒体自噬。本研究发现BRCA1可以在细胞核和细胞质中发挥不同的作用来维持线粒体的功能。在细胞核内,BRCA1可以通过调控线粒体融合蛋白的表达来影响线粒体的融合;在细胞质中,BRCA1在线粒体损伤下可转移到线粒体外膜上,通过促进线粒体的分裂来维持线粒体自噬活性。然而,在BRCA1缺失条件下,乳腺细胞中线粒体自噬活性会被削弱, 导致大量受损线粒体的积累及活性氧的增加,并激发炎症小体的活性。这一过程将诱发肿瘤相关巨噬细胞的募集来抑制CD8+T细胞的活性,从而改变BRCA1缺失乳腺的免疫微环境来促进肿瘤发生及转移。因此,采用炎症小体抑制剂如Glibenclamide等可有效地缓解BRCA1缺失乳腺癌的复发和转移,这为治疗三阴性乳腺癌开拓了新的方向。本研究由健康科学学院院长邓初夏、副教授徐晓玲、高级导师陈强(第一作者)等共同完成。有关论文详情,可浏览:
https://onlinelibrary.wiley.com/doi/10.1002/advs.201903616
邓初夏讲座教授为澳门大学健康科学学院院长。1995-2014年在美国国立卫生研究院任终身研究员和遗传研究室主任,其后作为健康科学学院创院院长加入澳门大学。他是乳腺癌研究领域专家,在乳腺癌的发生发展、耐药和转移的分子机制方面做了长期深入的研究,已发表论文380余篇,H指数为131(Google Scholar)。
陈强博士现为澳门大学健康科学学院高级导师,于厦门大学获得细胞生物学专业哲学博士学位,并在美国国立卫生研究院进行博士后培训;主要从事癌症发展及代谢疾病等相关基础研究。