 系列金属多酚网络纳米粒作用原理
系列金属多酚网络纳米粒作用原理
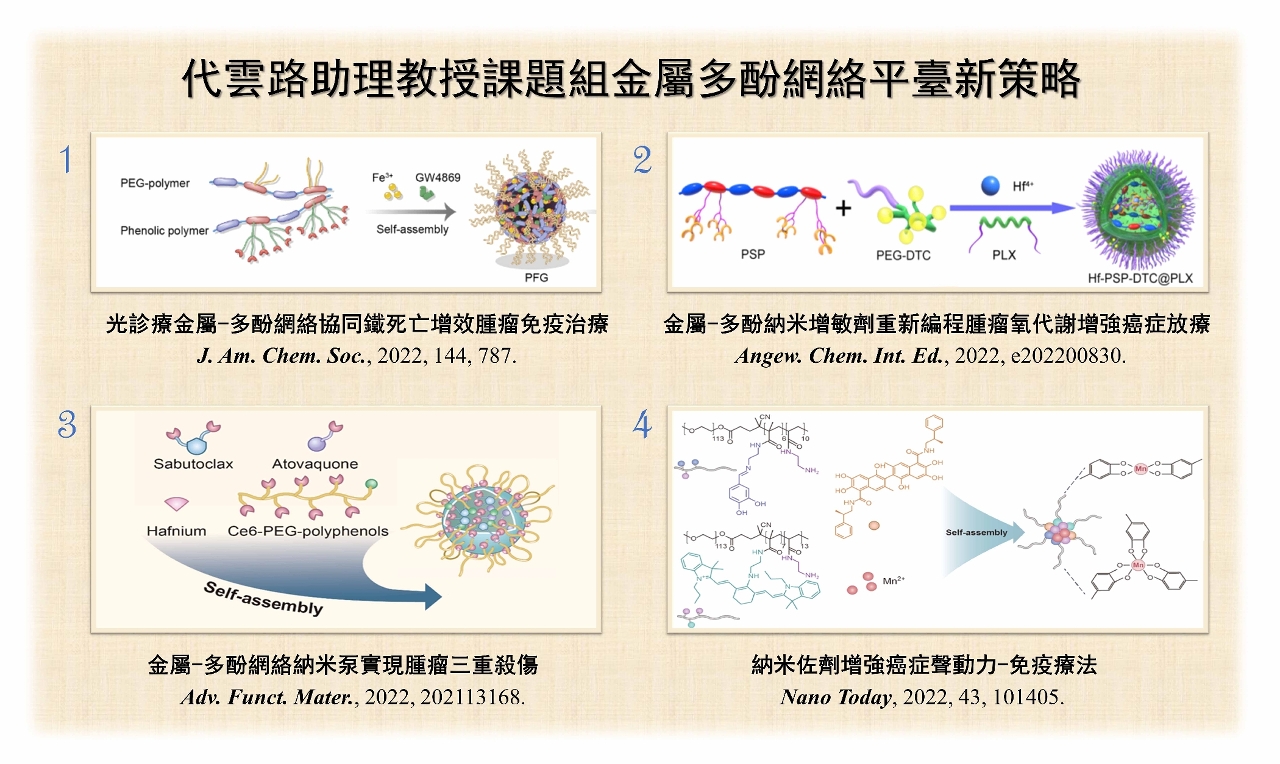
澳门大学健康科学学院助理教授代云路带领的研究团队成功开发一系列新型金属多酚纳米粒,能提升多种肿瘤治疗效果,为癌症提供新的治疗策略。相关研究成果已获国际着名学术期刊《美国化学会志》(Journal of the American Chemical Society)、《应用化学》(Angewandte Chemie International Edition)、《先进功能材料》(Advanced Functional Materials)和《今日纳米》(Nano Today)刊登。
纳米技术近年发展飞速,而具有癌症诊断、成像和治疗的多功能诊疗纳米复合材料不断被开发及利用。多酚材料是一类具有多羟基的酚类化合物,有良好生物相容性、多样药理活性、与金属配位等优良特性。研究团队把功能性分子(光敏剂、成像分子或抗癌药物)进行多酚修饰,开发集合多种功能的多酚衍生物模块,为癌症提供新的治疗策略。
在肿瘤微环境中,外泌体表面的PD-L1过度表达会导致免疫治疗失败。团队构建光诊疗金属多酚纳米粒(PFG),协同光热治疗以及铁死亡可以增强肿瘤免疫原性死亡,能激发抗肿瘤的免疫效应。PFG具有卓越的近红外二区萤光及光声成像性能,可用于精准光热治疗,同时,PFG中的GW4869能有效抑制外泌体的PD-L1表达,从而促进功能性T细胞增殖,这种联合策略是精准恶性肿瘤免疫治疗的新突破,同时也为外泌体免疫疗法提供新思路。鉴于新型材料具近红外二区萤光成像的精准性,团队通过两亲性聚合物装载酸敏感的硫化氢供体,螯合金属铪离子的多酚半导体聚合物,形成了金属多酚纳米增敏剂(Hf-PSP-DTC@PLX),实现诊疗一体化。该纳米增敏剂能产生合理剂量的硫化氢,抑制线粒体呼吸并降低肿瘤细胞耗氧量,有效改善肿瘤细胞的氧合效果。
现时金属铪元素作为放疗增敏剂已进入临床实验阶段,但放疗耐受性仍然是待解决的问题。有见及此,团队构建另一种新型铪金属多酚网络,实现肿瘤放疗、放动力治疗及免疫治疗的三重杀伤。该纳米粒结合anti-PD-L1抗体能缓解由结合治疗引起的肿瘤耐受性。金属铪元素与多酚配位构成纳米泵,同时嵌入atovaquone和sabutoclax,达到缓解肿瘤部位缺氧及加速肿瘤凋亡的目的。纳米泵包裹的sabutoclax不仅可以加速细胞凋亡信号的激活,亦可降低肿瘤微环境中谷胱甘肽的水平。另外,团队亦开发了金属多酚配位的纳米佐剂,能有效降低谷胱甘肽水平以提高声动力疗法,在锰离子的作用下,激活cGAS-STING通路,加强体内免疫反应,激活癌症免疫治疗。上述的金属多酚纳米粒在精准癌症治疗领域发展前景广阔。
是次研究的通讯作者均为代云路,第一作者为健康科学学院博士后谢丽斯和李杰,以及博士生桑玮和田浩。代云路团队的所有成员均对相关研究做出重要贡献。研究由国家自然科学基金(檔案编号:32171318和32101069)、澳门大学(檔案编号:SRG2018-00130-FHS)、国家教育部澳门大学精准肿瘤学前沿科学中心、澳门特别行政区科学技术发展基金(檔案编号:0109/2018/A3、0011/2019/AKP、0113/2019/A2和0103/2021/A)和深港澳科技计划(C类)(檔案编号:SGDX20201103093600004)资助。有关研究全文可浏览:https://pubs.acs.org/doi/10.1021/jacs.1c09753 https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202200830
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202113168 https://www.sciencedirect.com/science/article/pii/S1748013222000329



