 澳大最新研究發現抑制乳腺癌轉移和復發新機制
澳大最新研究發現抑制乳腺癌轉移和復發新機制
由澳門大學健康科學學院院長鄧初夏教授帶領的研究團隊發現,乳腺癌相關基因1(BRCA1)可通過促進線粒體自噬及降低炎症小體活性,抑制手術後乳腺癌的復發及轉移。此研究獲國家自然科學基金、澳門大學和澳門科技發展基金會資助,並作為封面文章發表在國際著名期刊《Advanced Science》(《先進科學》)。
全球癌症統計(GLOBOCAN)數據顯示,2018年全球有大約1810萬癌症新發病例和960萬癌症死亡病例,而其中女性乳腺癌佔210萬例,63萬人死亡,已成為威脅女性健康的第一癌症殺手。臨床上可對乳腺癌進行病理分型,其中雌激素受體(ER)、孕酮受體(PR)和表皮生長因子受體-2(Her-2)均為陰性的乳腺癌稱為三陰性乳腺癌,佔所有乳腺癌病理類型的10.0-20.8%。這類癌症缺乏獲批准的靶向治療方法並且易復發及轉移,是最為難治及惡性程度最高的乳腺癌。因此,當前迫切需要為三陰性乳腺癌治療找到新穎有效的靶標。
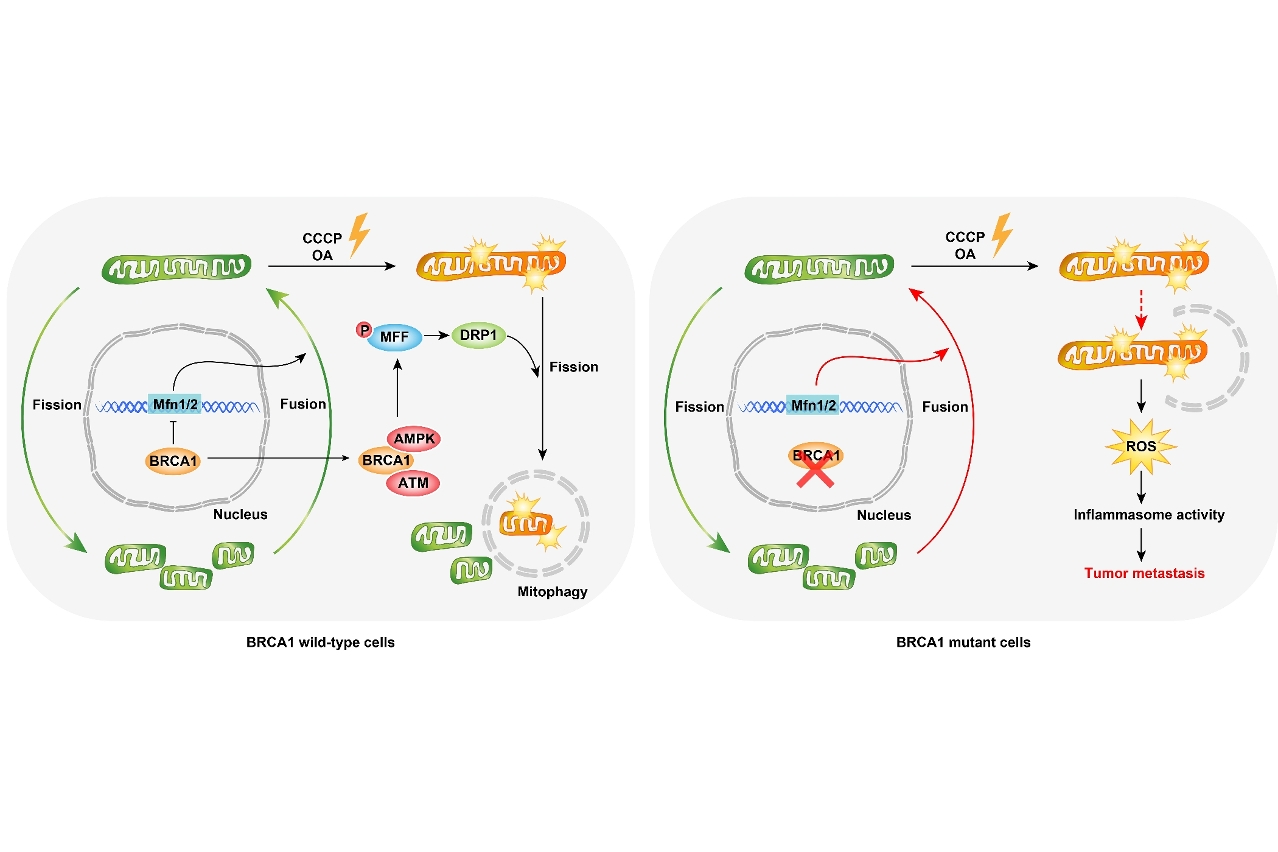
BRCA1是重要的抑癌基因,在維持細胞基因組穩定性中發揮重要作用,其突變提高女性罹患乳腺癌的風險,是導致遺傳型乳腺癌的主要原因,並且多數為三陰性乳腺癌。最近,澳門大學健康科學學院研究團隊利用攜帶BRCA1乳腺特異敲除的小鼠進行研究,發現BRCA1在線粒體自噬及線粒體動力學方面具有重要調控作用,可通過促進線粒體自噬清除損傷線粒體及降低炎症小體活性來抑制手術後乳腺癌的復發及轉移。
線粒體是在大多數真核細胞中存在的雙膜結構及高度動態的細胞器,可以通過分裂及融合的協調循環即線粒體動力學,來保持形狀、分佈和大小。線粒體不僅是細胞的動力工廠,而且在細胞信號轉導及細胞死亡等方面也具有重要作用。因此,維持正常的線粒體功能對於細胞的健康至關重要。近年來,研究表明受損的線粒體可通過與溶酶體融合形成自噬體而水解消化,從而及時清除受損的線粒體來維持細胞的完整性,這一過程稱為線粒體自噬。本研究發現BRCA1可以在細胞核和細胞質中發揮不同的作用來維持線粒體的功能。在細胞核內,BRCA1可以通過調控線粒體融合蛋白的表達來影響線粒體的融合;在細胞質中,BRCA1在線粒體損傷下可轉移到線粒體外膜上,通過促進線粒體的分裂來維持線粒體自噬活性。然而,在BRCA1缺失條件下,乳腺細胞中線粒體自噬活性會被削弱, 導致大量受損線粒體的積累及活性氧的增加,並激發炎症小體的活性。這一過程將誘發腫瘤相關巨噬細胞的募集來抑制CD8+T細胞的活性,從而改變BRCA1缺失乳腺的免疫微環境來促進腫瘤發生及轉移。因此,採用炎症小體抑制劑如Glibenclamide等可有效地緩解BRCA1缺失乳腺癌的復發和轉移,這為治療三陰性乳腺癌開拓了新的方向。本研究由健康科學學院院長鄧初夏、副教授徐曉玲、高級導師陳強(第一作者)等共同完成。有關論文詳情,可瀏覽:
https://onlinelibrary.wiley.com/doi/10.1002/advs.201903616
鄧初夏講座教授為澳門大學健康科學學院院長。1995-2014年在美國國立衛生研究院任終身研究員和遺傳研究室主任,其後作為健康科學學院創院院長加入澳門大學。他是乳腺癌研究領域專家,在乳腺癌的發生發展、耐藥和轉移的分子機制方面做了長期深入的研究,已發表論文380餘篇,H指數為131(Google Scholar)。
陳強博士現為澳門大學健康科學學院高級導師,於廈門大學獲得細胞生物學專業哲學博士學位,並在美國國立衛生研究院進行博士後培訓;主要從事癌症發展及代謝疾病等相關基礎研究。