 澳大仿生納米新藥有效治療動脈粥樣硬化
澳大仿生納米新藥有效治療動脈粥樣硬化
《自然通訊》(Nature Communications)今(26)日刊登了澳門大學的最新研發成果——一種基於巨噬細胞膜包載的仿生納米製劑,可有效治療動脈粥樣硬化,且無毒副作用。同時該研究也是世界上首次在炎症疾病模型中將細胞仿生納米製劑和活細胞製劑進行對比研究,可為該領域的科研工作者在後續研究中選擇合適劑型提供指導。
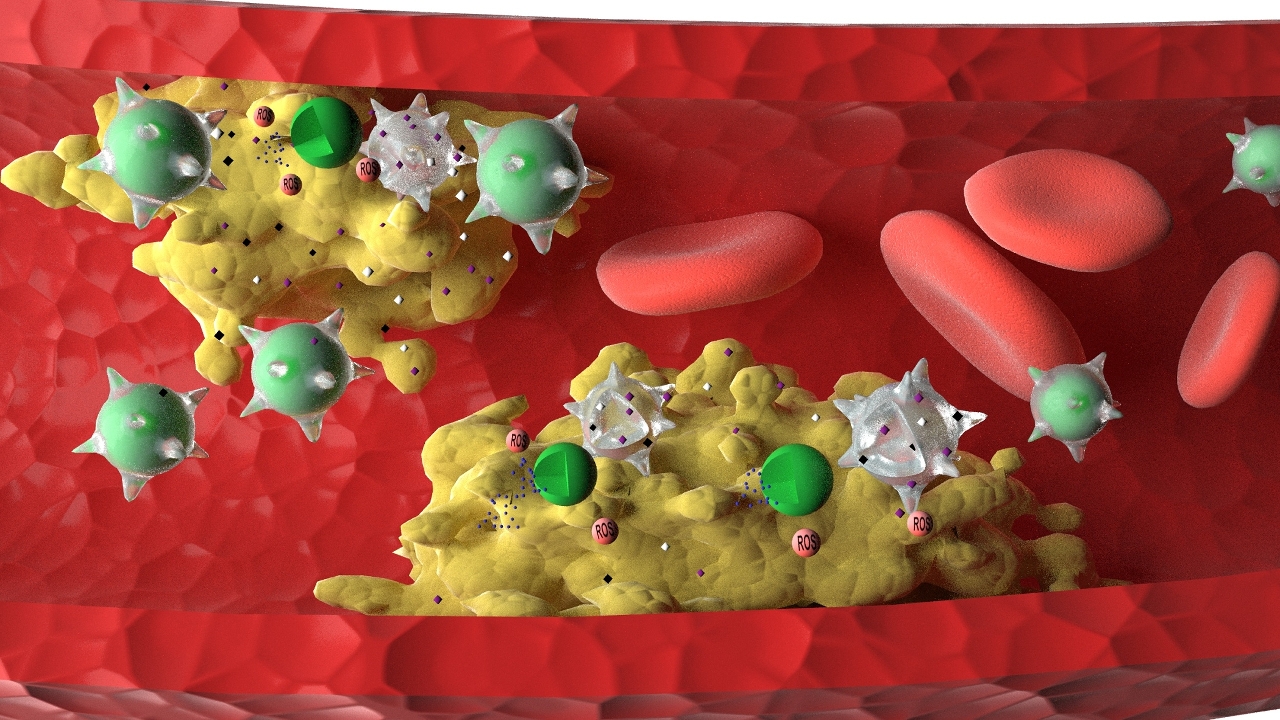
動脈粥樣硬化是心腦血管疾病如冠心病和腦梗死的主要原因,嚴重威脅人類的生命和健康。其病因是粥樣斑塊沉積在血管壁,造成動脈狹窄,現有藥物雖可減緩該病進程,但尚不能治癒,且毒副作用較大。針對這一問題,澳大中華醫藥研究院王瑞兵課題組和李銘源課題組合作,從發病機制上尋找新的突破點,開發了一種基於巨噬細胞膜包載的仿生納米製劑,可靶向遞送藥物至斑塊部位並有效逆轉小鼠動脈粥樣硬化進程,且無毒副作用。該研究首次對比了該新型“仿生納米製劑”和另一種新興的“活細胞製劑”的療效,詳細闡明了差異化原因。
根據粥樣斑塊部位高表達的活性氧水平,研究團隊以阿托伐他汀為模型藥物,製備了活性氧敏感型載藥納米粒,並進一步構建了巨噬細胞膜包裹藥物載體的仿生納米製劑,和吞噬藥物載體的巨噬細胞(活細胞)製劑。在對小鼠動脈粥樣硬化模型中,該仿生納米製劑能顯著提高載藥納米粒在斑塊部位的富集,通過響應高水平活性氧釋放被包裹的藥物,且比活細胞製劑更好地緩解並逆轉動脈粥樣斑塊的形成。
王瑞兵表示:“這主要是因為巨噬細胞膜可結合斑塊部位的炎症因子,從而降低炎症水平,並與阿托伐他汀協同發揮抗炎作用。然而,巨噬細胞(活細胞)製劑在斑塊炎症環境中可被啟動促炎機制,因而整體抗炎效果要差一些。”
此項研究獲澳門特別行政區科學技術發展基金資助(檔案編號:0121/2018/A3)與澳大研究基金支持。澳大王瑞兵副教授和李銘源教授為文章通訊作者,澳大博士生高成、黃俏賢(澳大濠江博士獎學金得主)和碩士生劉聰蕙為該文章的共同第一作者,澳大副教授萬建波、博士生岳魯丹、碩士生鄺熙婷亦為本研究作出重要貢獻。
相關研究成果以“仿生納米製劑通過靶向藥物治療協同截取促炎因子致動脈粥樣硬化消退”(Treatment of atherosclerosis by macrophage-biomimetic nanoparticles via targeted pharmacotherapy and sequestration of proinflammatory cytokines)為題發表於全球學術界知名《自然》(Nature)期刊的綜合性子刊——《自然通訊》。研究詳情可參閱:https://www.nature.com/articles/s41467-020-16439-7