 研究團隊運用全外顯子測序技術揭示了腫瘤的進化過程
研究團隊運用全外顯子測序技術揭示了腫瘤的進化過程
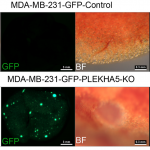
澳門大學健康科學學院副教授徐曉玲的研究團隊運用全外顯子測序技術,同時對BRCA1缺陷的乳腺組織和腫瘤進行了單細胞的單核甘酸突變和拷貝數變異分析,揭示了腫瘤的進化過程。研究團隊更發現了一個新的乳腺癌轉移抑制基因PLEKHA5,這個基因的缺失會促進乳腺癌的轉移,是乳腺癌領域的一個重要發現。這項研究成果已在全球著名學術期刊《自然通訊》(Nature Communications)上發表。
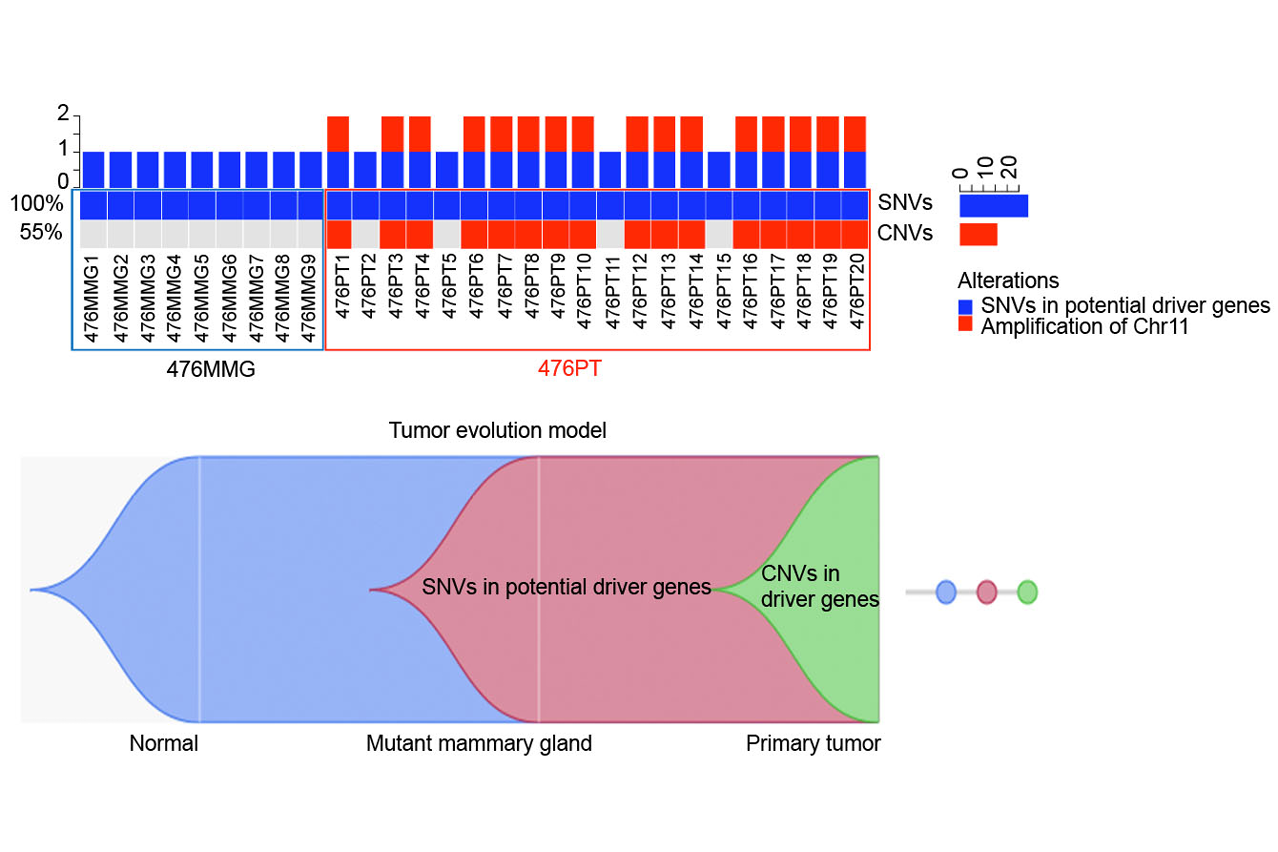
乳腺癌易感基因BRCA1突變是大約四分之一的人類家族性遺傳乳腺癌的起因,帶有BRCA1基因遺傳性突變的女性在其一生中患乳腺癌的風險高達40-80%。說到癌症,每個病人,甚至來源同一個病人的不同腫瘤的驅動事件都有可能是不一樣的,這需要進一步的研究闡明。目前BRCA1缺陷的乳腺癌的起始,以及其怎樣從早期的癌變前階段一步步惡變、進化、發展、轉移的生物學機制和原理尚不完全清楚。近年來,單細胞全外顯子測序技術已經成為了一個強有力的工具去破譯腫瘤的瘤內異質性,並鑒定癌症的驅動因子。但是,目前同時分析來自同一個細胞的單核甘酸突變和拷貝數變異仍極具挑戰性。
為了理解BRCA1缺陷的乳腺癌的基因突變特徵、進化過程、以及鑒定其腫瘤驅動事件,該研究團隊運用全外顯子測序技術,同時對BRCA1缺陷的乳腺和腫瘤進行了單細胞的單核甘酸突變和拷貝數變異分析,並用基因編輯工具CRISPR-Cas9對候選的驅動基因進行了體外和體內的功能驗證。該研究有以下重要發現:1. BRCA1-缺陷的腫瘤進化起始於癌變前帶有單核甘酸突變驅動基因的細胞,隨著染色體通過自然選擇不斷累積癌症驅動基因的拷貝數變異,腫瘤發生進一步的惡化、生長、轉移。2. 在每個不同的腫瘤內,這些突變是隨機事件,可以影響很多癌基因,從而導致每個腫瘤獨特的基因突變特徵和病理特徵。3. 當癌症或者轉移的驅動事件發生在惡化前或者在低頻率的時候,由於瘤內異質性的原因,組織塊測序其很有可能檢測不到這些低頻事件,但單細胞可以測序可以解決這一問題。4. PLEKHA5就是這樣一個例子,其突變存在於一小部分原位腫瘤細胞,但是在肝轉移的腫瘤中佔據了主導地位。5. CRISPR-Cas9介導的功能驗證實驗證明PLEKHA5不影響原位腫瘤的生長,然而它的缺陷可以促進腫瘤的肝轉移和肺轉移,說明它是一個癌症轉移抑制基因。
這項研究由徐曉玲主導,博士研究生劉建林為第一作者。健康科學學院講座教授鄧初夏、副教授黃冠豪、研究助理教授苗凱、研究助理Ragini ADHAV和博士研究生舒適文也為該研究做出了重要貢獻。該研究得到了澳門大學(檔案編號:MYRG2016-00138-FHS、MYRG2017-00088-FHS、 MYRG2019-00064-FHS)和澳門特別行政區科學技術發展基金(檔案編號:027/2015/A1、 029/2017/A1、 0101/2018/A3、0011/2019/AKP)的資助。