 多酚及其衍生物相結合的酚納米藥物有效抑制腫瘤的生長和轉移
多酚及其衍生物相結合的酚納米藥物有效抑制腫瘤的生長和轉移
澳門大學健康科學學院助理教授代雲路領導的科研團隊通過研究多酚及其衍生物相結合的納米藥物,實現了腫瘤化療與光動力治療的巧妙結合,有效抑制腫瘤的生長和轉移。此新型治療策略已刊登於國際頂級學術期刊《德國應用化學》(Angewandte Chemie International Edition)。
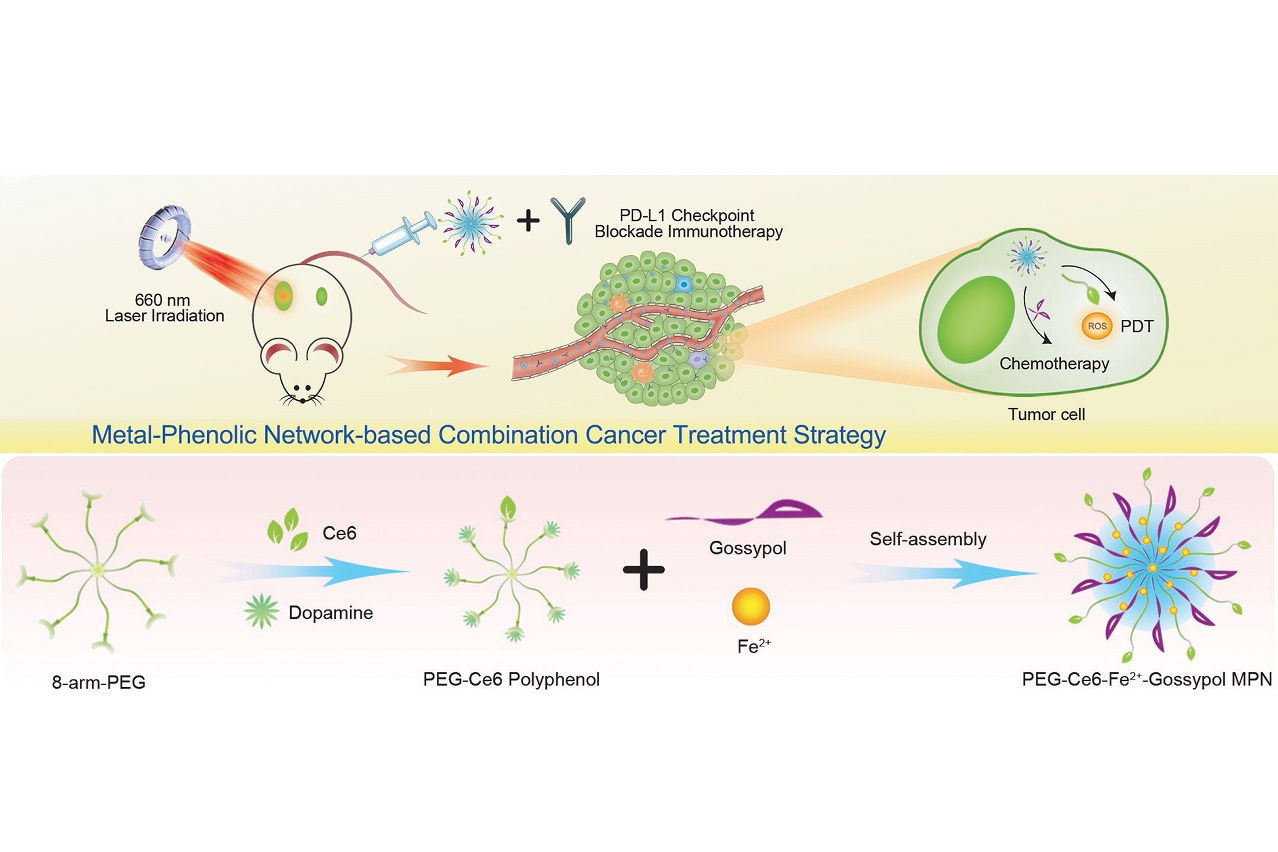
研究團將提取於棉花種子的天然多酚-棉酚與通過化學合成的具有光敏性質的卟吩-多酚衍生物相結合,使其與金屬配位而形成具有穩定結構的金屬-多酚多功能網絡。多酚廣泛存在於自然界的各種植物中,是植物體內的重要有機成分。其獨特的酚羥基結構及物理特性使其具有特定的生理功效,可應用於預防退行性疾病及對抗癌症等。此多酚納米藥物實現了腫瘤化療與光動力治療的巧妙結合。治療後通過促進腫瘤抗原遞呈細胞的成熟,抗腫瘤細胞因數的釋放等作用,有效增強了基於PD-L1檢查點抑制的腫瘤免疫療法,實現“多專多能”啟動免疫應答,從而有效抑制腫瘤的生長和轉移。
多酚的酚羥基與金屬離子可以通過配位螯合作用形成可逆的三維網絡結構,該共價偶聯性質賦予多酚優秀的功能化修飾特性,實現不同藥物的承載和靶向運送。澳大代雲路團隊利用獨特的金屬-多酚配位生物材料設計理念,進行天然多酚、多酚衍生物的模塊化合成和製備。在此研究中,團隊成員製備了具有光敏性質的卟吩-多酚衍生物,並將其與天然多酚-棉酚相結合,進一步與鐵離子配位,獲得納米化多酚藥物。
此納米製劑體積小,直徑約30納米,可有效積累於腫瘤組織。其同時具有環境響應性藥物釋放特性,在血液環境中結構穩定,可實現長時間血液循環。但在腫瘤組織的酸性環境中,藥物棉酚可被快速釋放並與細胞內凋亡相關蛋白結合,促進細胞死亡。鐳射照射此納米藥物可誘發產生大量活性氧,造成腫瘤細胞DNA損傷,協同棉酚促進腫瘤細胞死亡。此納米藥物可引起機體對腫瘤的強烈免疫應答,引起大量抗腫瘤細胞因數的釋放及T細胞在腫瘤組織的浸潤,顯著抑制腫瘤生長和轉移。
有關論文《基於多酚的納米藥物通過喚醒免疫應答用於腫瘤聯合治療》的通訊作者為代雲路,其博士生張展、桑瑋及澳大濠江博士後謝麗斯為文章共同第一作者。澳門大學健康科學學院副教授袁振,助理教授趙琦,博士後李蓓、李傑及博士生李文曦和田浩亦作出重要貢獻。此項研究由澳門特別行政區科學技術發展基金資助(檔案編號:0109/2018/A3 和0011/019/AKP)及由澳門大學資助(檔案編號:SRG2018-00130-FHS)。全文可瀏覽:https://doi.org/10.1002/anie.202013406