 抑制蛋白酶體的活性可以阻斷多種類型癌症的廣譜耐藥性
抑制蛋白酶體的活性可以阻斷多種類型癌症的廣譜耐藥性
澳門大學健康科學學院院長鄧初夏領導的研究小組發現了泛素化蛋白酶體系統與藥物耐受之間的聯繫,研究顯示通過抑制蛋白酶體的活性可以阻斷多種類型癌症的廣譜耐藥性。相關研究成果有助解決癌症病人的耐藥性問題,已獲國際知名期刊《先進科學》(Advanced Science)刊登。
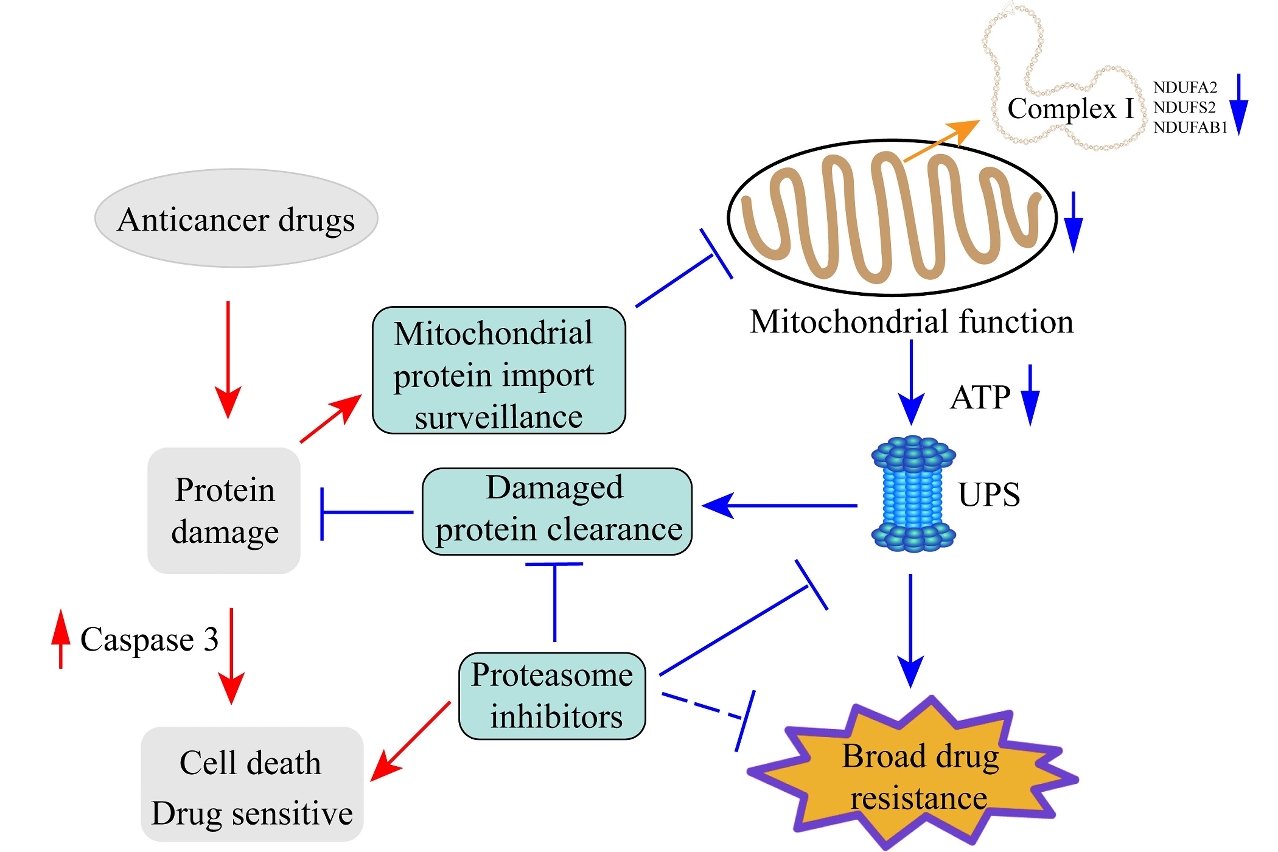
癌症死亡率一直居高不下的重要原因是因為人體會自動對藥物產生耐藥性,當癌細胞同時或依次用幾種藥物治療時,它們可能會變成多藥耐藥性,致使這類癌症非常難以治療,例如腫瘤細胞原發性耐藥、獲得性耐藥等。許多腫瘤即使在化療處理初期效果很好,但是細胞會逐漸獲得耐藥性而得不到控制。此外,許多癌症在經一種藥物治療後,往往演變成對其它許多未接觸過而且結構不同、作用機制各異的藥物也產生交叉耐藥性,即廣譜耐藥性,令許多尖端醫療機構束手無措。研究小組通過全基因組RNAi篩選和進化耐藥模型,發現增強的蛋白酶體活性和較低的線粒體活性促進了順鉑耐藥性。順鉑是目前臨床應用最廣泛的化療藥物之一,用以治療各種不同類型的癌症。進一步的研究表明,順鉑治療可引起蛋白質損傷,從而觸發線粒體蛋白質輸入監測通路的啟動。線粒體蛋白輸入監測通路的啟動一方面導致線粒體活性的降低,另一方面能夠啟動蛋白酶體活性,從而增加受損蛋白的清除率並拯救細胞活力。另外,研究團隊通過比對69種藥物文庫的篩選和患者類器官的篩選,證實增強的蛋白水解作用和較低的線粒體活性是耐受多達40種抗癌藥物的共同機制,而蛋白酶體抑制劑治療逆轉了對其中27種藥物的耐受性。研究成果進一步顯示,通過納米顆粒包備的順鉑和硼替佐米可以進一步增強了抗腫瘤的功效,並減輕了藥物聯合治療引起的副作用。
研究團隊在通過全基因組RNAi篩選來鑒定可能與耐藥有關的所有人類基因時共發現45個基因與順鉑耐藥有關,104個基因與順鉑敏感有關。他們使用多種模型展示了靶向這些候選基因所參與的細胞功能能夠克服廣譜耐藥性。這些研究表明儘管不同的抗癌藥物具有不同的結構,細胞靶標和作用機制,但癌細胞會啟動相似的防禦系統以維持細胞存活。研究證明增強的蛋白水解作用是這些耐藥性的常見機制之一,而通過靶向這一通用的防禦系統,能夠逆轉多種藥物的耐受。這些發現在轉化醫學中具有重要意義。
這項研究由健康科學學院院長鄧初夏領導,博士生邵方元為第一作者,鏡湖醫院和山頂醫院亦參與部份研究工作。相關研究由澳門特別行政區科學技術發展基金資助(檔案編號:094/2015/A3, 048/2019/A1和0011/2019/AKP)和澳門大學資助(檔案編號:CPG2020-00004-FHS、MYRG2016-00139-FHS、MYRG2016-00132-FHS和MYRG2017-00113-FHS)。全文可瀏覽:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202001914