 系列金屬多酚網絡納米粒作用原理
系列金屬多酚網絡納米粒作用原理
澳門大學健康科學學院助理教授代雲路帶領的研究團隊成功開發一系列新型金屬多酚納米粒,能提升多種腫瘤治療效果,為癌症提供新的治療策略。相關研究成果已獲國際著名學術期刊《美國化學會誌》(Journal of the American Chemical Society)、《應用化學》(Angewandte Chemie International Edition)、《先進功能材料》(Advanced Functional Materials)和《今日納米》(Nano Today)刊登。
納米技術近年發展飛速,而具有癌症診斷、成像和治療的多功能診療納米複合材料不斷被開發及利用。多酚材料是一類具有多羥基的酚類化合物,有良好生物相容性、多樣藥理活性、與金屬配位等優良特性。研究團隊把功能性分子(光敏劑、成像分子或抗癌藥物)進行多酚修飾,開發集合多種功能的多酚衍生物模塊,為癌症提供新的治療策略。
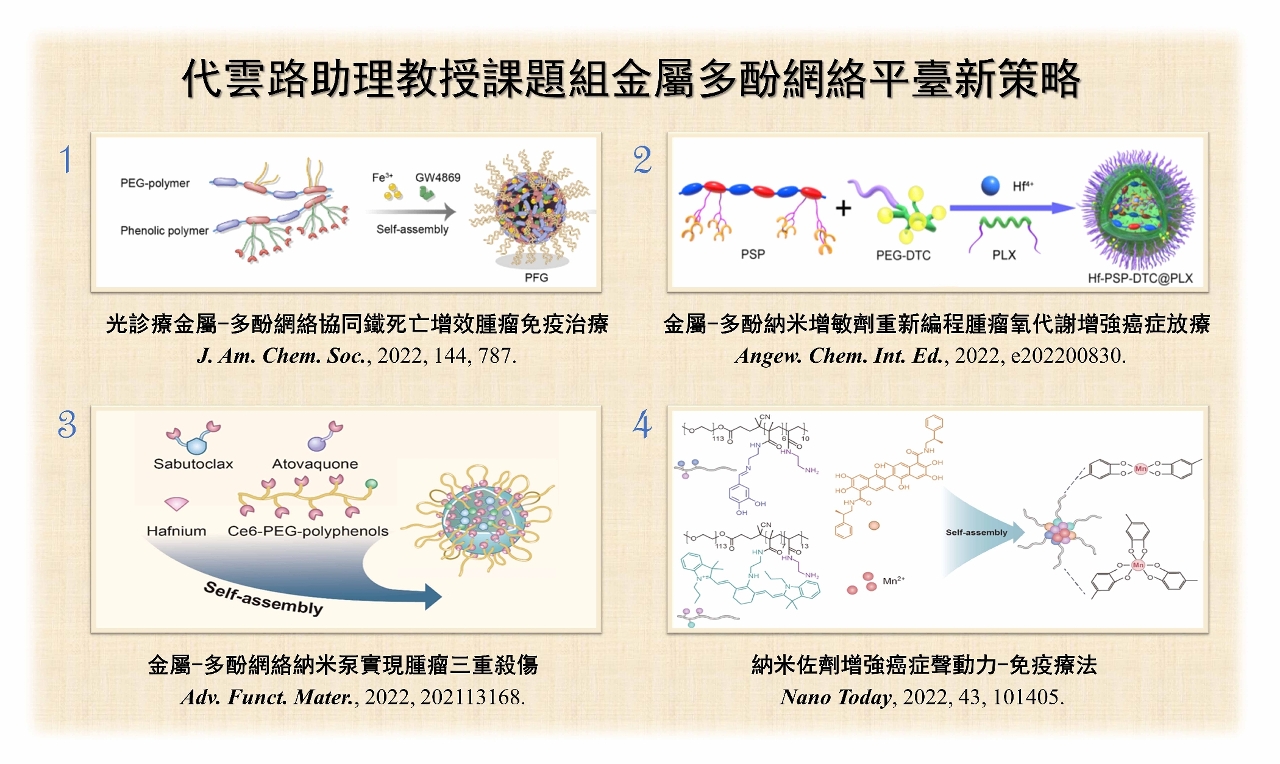
在腫瘤微環境中,外泌體表面的PD-L1過度表達會導致免疫治療失敗。團隊構建光診療金屬多酚納米粒(PFG),協同光熱治療以及鐵死亡可以增強腫瘤免疫原性死亡,能激發抗腫瘤的免疫效應。PFG具有卓越的近紅外二區螢光及光聲成像性能,可用於精準光熱治療,同時,PFG中的GW4869能有效抑制外泌體的PD-L1表達,從而促進功能性T細胞增殖,這種聯合策略是精準惡性腫瘤免疫治療的新突破,同時也為外泌體免疫療法提供新思路。鑑於新型材料具近紅外二區螢光成像的精準性,團隊通過兩親性聚合物裝載酸敏感的硫化氫供體,螯合金屬鉿離子的多酚半導體聚合物,形成了金屬多酚納米增敏劑(Hf-PSP-DTC@PLX),實現診療一體化。該納米增敏劑能產生合理劑量的硫化氫,抑制線粒體呼吸並降低腫瘤細胞耗氧量,有效改善腫瘤細胞的氧合效果。
現時金屬鉿元素作為放療增敏劑已進入臨床實驗階段,但放療耐受性仍然是待解決的問題。有見及此,團隊構建另一種新型鉿金屬多酚網絡,實現腫瘤放療、放動力治療及免疫治療的三重殺傷。該納米粒結合anti-PD-L1抗體能緩解由結合治療引起的腫瘤耐受性。金屬鉿元素與多酚配位構成納米泵,同時嵌入atovaquone和sabutoclax,達到緩解腫瘤部位缺氧及加速腫瘤凋亡的目的。納米泵包裹的sabutoclax不僅可以加速細胞凋亡信號的激活,亦可降低腫瘤微環境中穀胱甘肽的水平。另外,團隊亦開發了金屬多酚配位的納米佐劑,能有效降低穀胱甘肽水平以提高聲動力療法,在錳離子的作用下,激活cGAS-STING通路,加強體內免疫反應,激活癌症免疫治療。上述的金屬多酚納米粒在精準癌症治療領域發展前景廣闊。
是次研究的通訊作者均為代雲路,第一作者為健康科學學院博士後謝麗斯和李傑,以及博士生桑瑋和田浩。代雲路團隊的所有成員均對相關研究做出重要貢獻。研究由國家自然科學基金(檔案編號:32171318和32101069)、澳門大學(檔案編號:SRG2018-00130-FHS)、國家教育部澳門大學精準腫瘤學前沿科學中心、澳門特別行政區科學技術發展基金(檔案編號:0109/2018/A3、0011/2019/AKP、0113/2019/A2和0103/2021/A)和深港澳科技計劃(C類)(檔案編號:SGDX20201103093600004)資助。有關研究全文可瀏覽:https://pubs.acs.org/doi/10.1021/jacs.1c09753 https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202200830
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202113168 https://www.sciencedirect.com/science/article/pii/S1748013222000329